
iPS細胞をはじめとした細胞を用いる再生医療は、次世代医療の中でも最も注目を浴びる領域です。その世界市場は造血幹細胞移植で4830億円 (2024年予想)、CAR-T細胞など遺伝子改変細胞を含む細胞製剤では6.9兆円 (2040年予想)と増加の一途です[i]。
ネクスジェン株式会社は、骨髄に含まれる細胞のうち数万個に1個と言われる造血幹細胞の中でも、さらに極めて少なく、生涯にわたり自己複製能と多分化能を有し、移植治療後の長期間の生存率を大きく改善する可能性のある”長期造血幹細胞(long-term haematopoietic stem cell; LT-HSC)”の単離技術およびこの細胞を試験管内で増幅させる培養技術の開発に取り組んでいます。(図:次世代造血幹細胞移植の流れ)
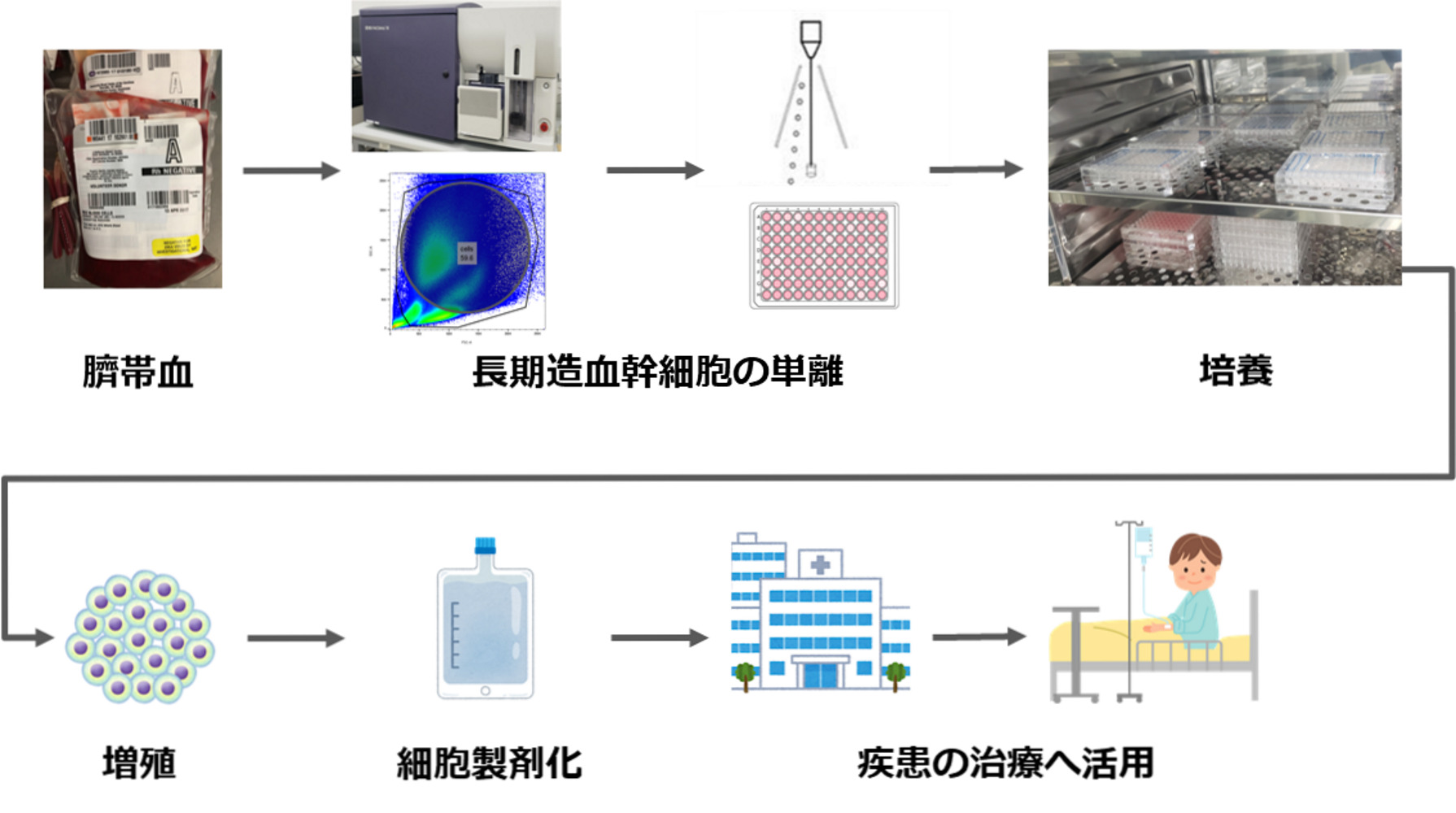
造血幹細胞移植では、ドナー不足・ドナーからの採取時の負担・HLA(Human Leukocyte Antigen=ヒト白血球抗原)の不一致・副作用や合併症のリスク・年齢や健康状態の制限など様々な問題が指摘されています。
その1つとしてGVHD(graft-versus-host disease:移植片対宿主病)があります。これは、造血幹細胞移植において命に関わる重大な副作用の一つです。移植された造血幹細胞浮遊液に含まれるドナー由来のリンパ球の一種T細胞が患者の細胞を非自己とみなし、免疫反応(生体防御反応)が起こり、患者の正常細胞を攻撃します。その結果、皮疹、下痢、肝障害をはじめとした様々な障害が全身に起こり、重症化すると治療が困難で命に関わることもあります。重症GVHD発症率はHLA適合非血縁者間移植では約13%と報告されています[ii]。
GVHDの予防にはT細胞を除去することが有効であり、造血幹細胞が含まれると言われているCD34陽性細胞のみの移植や特定の細胞(TCRαβ細胞)を除去する試みが検討されています[iii]。一方、ドナー由来T細胞による患者組織の攻撃は悪いことばかりでなく、患者の白血病細胞を攻撃する移植片対白血病効果(graft versus leukemia effect: GVL 効果)も報告されており、T細胞を除去することが一概に良いとは言い切れず様々な議論がされています。
造血幹細胞の供給源として骨髄液や臍帯血などが用いられていますが、このなかには成人に移植するには十分な量の造血幹細胞が含まれていない場合も多く、細胞数が原因で移植を中断せざるを得ない場合もあります。この問題を解決するためには、造血幹細胞のみを増殖させる培養技術を開発することです。しかし、未分化な細胞である造血幹細胞は培養中に様々な細胞に分化することが多く、2020年現在、臨床応用可能な培養技術は未だ報告されていません。
ネクスジェン株式会社は長期造血幹細胞の単離技術を開発し[iv]、その培養法および細胞製剤化の開発に取り組んでいます。
長期造血幹細胞は移植した体内で長期間生存することが可能であり、ゆえに治療効果の長期間の持続が期待されます。よって、この細胞を選択的に増殖させる技術を開発することによって、これまで問題となっていたドナー不足、細胞不足による移植中止を免れる可能性があります。また、疾患の根治に本来必要な造血幹細胞のみを移植することで、GVHDをはじめとした重篤な副作用を大幅に低減、患者の生命予後を大きく改善する可能性があります。
造血幹細胞移植における細胞数不足や移植に伴う重篤な副作用の問題に対して、ネクスジェン株式会社は、長期造血幹細胞の単離および体外増幅・培養技術の開発により、これらの問題点を解決し、造血幹細胞移植の難易度を下げ、白血病をはじめとした血液疾患、さらには、造血幹細胞移植の有効性が検討されている自己免疫疾患、先天性代謝異常症などの多くの疾患の患者様の治療成績を向上させることを目指します。
ネクスジェン株式会社
〒650-0047 兵庫県神戸市中央区港島南町6-3-5
TEL:078-381-9455
Email: info@nextgem.jp